CARACTERE"MULTI-ETAPES " DE LA CANCEROGENESE
Les données épidémiologiques montrent que l'exposition à un carcinogène de l'environnement n'entraîne un risque de cancer cliniquement décelable qu'avec un délai de plusieurs années. Ceci laisse supposer que cette période de latence entre l'altération cellulaire fondamentale et la formation de la tumeur maligne, correspond à la survenue d'évènements cellulaires aux effets carcinogènes cumulatifs [JORDE, 2004].

Durant toute la vie cellulaire, notre patrimoine génétique (l'acide désoxyribonucléique ou ADN) est soumis à des agressions. Dans la majeure partie des cas, ces modifications de l'ADN passent inaperçues car des mécanismes réparateurs corrigent ces défauts. Pourtant, dans de rares cas, une mutation peut atteindre et modifier la structure d'un gène spécifiant un facteur qui règle le contrôle de la multiplication cellulaire (oncogène ou gène suppresseur de tumeur). Dans ce cas, la cellule peut acquérir un avantage sélectif qui lui permettra de donner naissance à un premier clone de cellules anormales (lésion précancéreuse). Dans ces cellules qui ont un avantage sélectif, la probabilité qu'une seconde mutation apparaisse et soit sélectionnée est plus importante. Dans ce cas, une seconde population sera générée, plus anormale que la première et qui va se développer à ses dépens. On peut ainsi, par diverses étapes successives, accumuler plusieurs mutations, chacune d'entre elles permettant la sélection d’un clone de plus en plus malin pour finir par une cellule hautement cancéreuse. La progression tumorale correspond donc à un processus dynamique qui, à chaque étape, sélectionne une nouvelle cellule ayant subi une ou plusieurs altérations. le schéma est tiré de l'encyclopédie en ligne "wikipédia"
Arguments cliniques et biologiques
Si une seule mutation était suffisante pour induire l'apparition d'une tumeur maligne, chacun de nos gènes qui subit environ 10 -6 mutations spontanées par division cellulaire aurait, à raison de 10 16 divisions cellulaires dans une vie, 10 -6 X 1016 = 1010 fois l'occasion d’entraîner l'apparition d'une tumeur maligne, ce qui ferait de nous une espèce pratiquement non viable.
L'apparition d'un clone cellulaire malin procède heureusement de l'accumulation dans une seule cellule d'évènements rares et non liés entre eux. L’on estime entre 2 et 7 le nombre d'évènements indépendants, non obligatoirement tous mutagènes, nécessaires dans une même cellule pour entraîner sa transformation en cellule maligne. Chaque étape correspond au franchissement d'un des obstacles qui s'opposent physiologiquement et en permanence au développement d'une prolifération cellulaire anarchique.
Le caractère "multi étapes" de la prolifération tumorale apparaît également à l'observation des cellules cancéreuses en culture où leur phénotype n'est pas strictement homogène : on peut distinguer les
cellules "immortalisées" (capables de prolifération indéfinie in vitro),
des cellules "transformées" (ayant perdu les caractères normaux d'adhésion cellulaire et d'inhibition de contact)
et des cellules "tumorigéniques" (capables d'induire la formation d'une tumeur par inoculation à la souris Nude), avec des modifications caryotypiques observables à chaque étape de la transformation.
Au cours de l'évolution de plusieurs types de cancers, on identifie au niveau tissulaire les étapes successives de l'aspect normal à l'aspect néoplasique en passant par différents états "pré-cancéreux",
Modifications cellulaires initiales :
Dans les systèmes d'expérimentation animale, les mécanismes de carcinogenèse ont été classés en trois grandes étapes : initiation, promotion et progression [CHOPIN, 2001]. Dans ces systèmes, il est possible de mettre en évidence l'action spécifique d'un agent cancérigène à une étape précise.
En cancérogenèse humaine, aucune de ces étapes n'est obligatoire et il n'existe aucune standardisation à ce niveau. Plus que ces trois étapes classiques, la carcinogenèse est le résultat d'une accumulation d'altérations génétiques et de variations dans la prolifération conduisant à la perte de l'homéostasie cellulaire et tissulaire . Dans ce processus complexe, certains agents cancérigènes peuvent agir de façon précoce (initiation) ou plus tardive (progression).
Ainsi, après l'exposition à un toxique (procarcinogène), celui-ci est habituellement métabolisé par l'organisme, ce qui assure sa transformation en carcinogène. A ce niveau, les possibilités d'inactivation et/ou d'élimination dépendent des systèmes enzymatiques qui assurent son métabolisme (phase I : fonctionnalisation ; phase II : détoxication ou détoxification). L'initiation du processus tumoral peut survenir à ce stade, suite à une ou plusieurs altérations génétiques ( schématisé si dessous). Elle consiste le plus souvent en une mutation/délétion d'une ou plusieurs bases de l'ADN [ROUSSELET-CHAPEAU, 2007]. Elle est rapidement induite par un carcinogène (virus, produits chimiques, rayons) sur des cellules souches ou des cellules différenciées et n'est pas obligatoirement transmise car elle peut être réparée ou déclencher la voie d'apoptose, ou encore persister sans entraîner d’autre transformation (mutation « neutre »). Les cellules initiées ne sont pas encore cancéreuses: n'ont pas acquis une autonomie de croissance [ROUSSELET-CHAPEAU, 2007].
Les possibilités de contrôle et de réparation à ce niveau dépendent de l'intégrité des gènes suppresseurs de tumeurs, en particulier du gène p53. Les altérations de l'expression génique et les mécanismes de la prolifération cellulaire peuvent ensuite transformer cette cellule précancéreuse en une population distincte de cellules cancéreuses. A ce stade, le développement tumoral peut être accéléré (« promotion ») par d'autres carcinogènes. Les agents promoteurs ne sont pas directement mutagènes et leurs effets sont réversibles. Ce sont : des hormones, des facteurs de croissance, une inflammation chronique, des agents chimiques alcool, sénescence [ROUSSELET-CHAPEAU, 2007]. Le clone en promotion prolifère a des besoins réduits en Facteurs de croissance et est moins sensible aux signaux extracellulaires inhibiteurs de la prolifération cellulaire [ROUSSELET-CHAPEAU, 2007]. Au cours de cette prolifération cellulaire accrue, surviennent des mutations additionnelles et seront transmises aux cellules filles (sans réparation ni apoptose) ROUSSELET-CHAPEAU, 2007].
Sous l'influence de l'accumulation des altérations génétiques, la tumeur progresse d'abord localement, puis en envahissant les tissus avoisinants et distants (métastase) [CHOPIN, 2001]. Cette étape est l’invasion locale. Des cellules tumorales se détachent de la tumeur envahissent le tissu conjonctif et détruisent les organes ; un processus complexe, lié à :
– acquisition de nouvelles propriétés biologiques génétiquement déterminées par certains sous clones de la tumeur
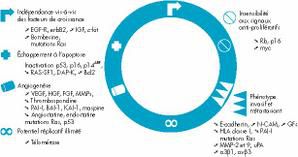
le schéma démontre les caractéristiques fondamentales d'une cellule cancéreuse, ces différentes étapes aboutissent à l'acquisition de six propriétés élémentaies de la cellule cancereuse. On le voit sur le schéma, certains gènes participants à plusieurs de ces propriétés, il est possible en inactivant un nombre réduit à trois ou quatre de ces gènes d'obtenir un phénotype complet (ex: Ras + p53 (+/- p14)+Rb ou p16+ télomérase).
– des facteurs du microenvironnement péri tumoral qui modulent les capacités d’invasion [ROUSSELET-CHAPEAU, 2007].
Le dernier stade de ces transformations est le phénomène de l’Angiogenèse, Une tumeur de moins de 1 à 2 mm de diamètre peut recevoir tous les nutriments par simple diffusion, mais la croissance tumorale ultérieure dépend du développement d'une vascularisation par néo-angiogenèse [ZALCMAN, 2001]. De fait, la commutation vers un phénotype angiogénique doit être précoce pour permettre le développement ultérieur d'une tumeur. Cette commutation (switch) angiogénique s'effectue donc dès les stades les plus précoces de la cancérogenèse [ZALCMAN, 2001].
Références
CHOPIN, 2001 , CHOPIN D., CAPPELLEN D., FRADVANYI F., GATTEGNO B. Tumeurs Superficielles de la Vessie Progrès en Urologie (2001), 11, 877-924
ROUSSELET-CHAPEAU, 2007, MC Rousselet-Chapeau, M1 STOS-UE physiopathologie des maladies cancereuses ; modèle général de la carcinogénèse multi étapes, avril, 2007
ZALCMAN, 2001, Gérard Zalcman Biologie du cancer bronchique : de la paillasse aux thérapeutiques innovantes médecine thérapeutique Vol.7 n° 7 ; 528-544 (2001)
